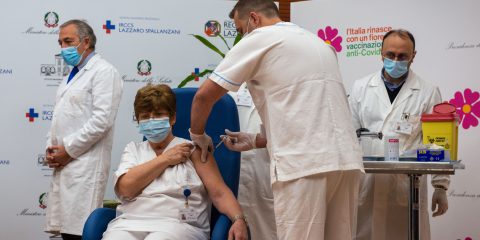
Dopo il ‘Vaccine day’ del 27 dicembre 2020, milioni di italiani vogliono conoscere tutte le informazioni utili, corrette e accurate sul vaccino destinato a prevenire il Covid per scegliere, liberamente, se farsi vaccinare.
Il primo vaccino anti Covid-19 somministrato da ieri in Italia si chiama Comirnaty prodotto da BioNTech/Pfizer: è stato approvato dall’European Medicines Agency (EMA), ma al medicinale è stata rilasciata un’autorizzazione “subordinata a condizioni”. Ciò significa che devono essere forniti ulteriori dati sul vaccino. L’Agenzia europea dei medicinali esaminerà almeno annualmente le nuove informazioni su questo medicinale.
Di seguito le domande più frequenti sul vaccino a cui ha risposto l’AIFA, l’Agenzia Italiana del Farmaco, l’istituzione pubblica competente per l’attività regolatoria dei farmaci in Italia.
Caratteristiche del vaccino
Che cos’è e a che cosa serve? Destinato a prevenire il Coronavirus
Il vaccino COVID-19 mRNA BNT162b2 (Comirnaty) è un vaccino destinato a prevenire la malattia da coronavirus 2019 (COVID-19) nei soggetti di età pari o superiore a 16 anni. Contiene una molecola denominata RNA messaggero (mRNA) con le istruzioni per produrre una proteina presente su SARS-CoV-2, il virus responsabile di COVID-19.
Il vaccino non contiene il virus e non può provocare la malattia.
Il vaccino anti-Covid è sicuro? Autorizzati dopo un’attenta valutazione
I vaccini vengono autorizzati solo dopo un’attenta valutazione del profilo di sicurezza in base agli studi effettuati nella fase di sperimentazione.
In ogni caso il profilo di sicurezza verrà continuamente monitorato anche dopo l’autorizzazione.
Come viene somministrato? A distanza di almeno 21 giorni l’una dall’altra
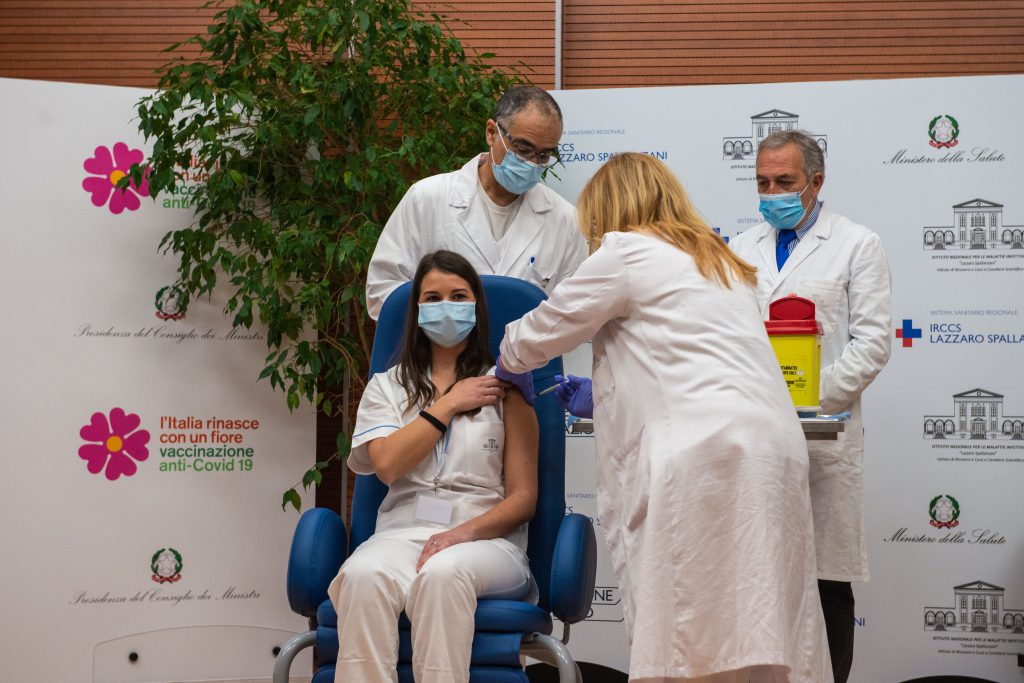
Il vaccino COVID-19 mRNA BNT162b2 (Comirnaty) viene somministrato in due iniezioni, solitamente nel muscolo della parte superiore del braccio, a distanza di almeno 21 giorni l’una dall’altra.

Come agisce? Le proteine prodotte stimolano il sistema immunitario a produrre anticorpi specifici
I virus SARS-CoV-2 infettano le persone utilizzando una proteina di superficie, denominata Spike, che agisce come una chiave permettendo l’accesso dei virus nelle cellule, in cui poi si possono riprodurre. Tutti i vaccini attualmente in studio sono stati messi a punto per indurre una risposta che blocca la proteina Spike e quindi impedisce l’infezione delle cellule. Il vaccino COVID-19 mRNA BNT162b2 (Comirnaty) è fatto con molecole di acido ribonucleico messaggero (mRNA) che contengono le istruzioni perché le cellule della persona che si è vaccinata sintetizzino le proteine Spike. Nel vaccino le molecole di mRNA sono inserite in una microscopica vescicola lipidica che permette l’ingresso del mRNA nelle cellule. Una volta iniettato, l’mRNA viene assorbito nel citoplasma delle cellule e avvia la sintesi delle proteine Spike.
Le proteine prodotte stimolano il sistema immunitario a produrre anticorpi specifici. In chi si è vaccinato e viene esposto al contagio virale, gli anticorpi così prodotti bloccano le proteine Spike e ne impediscono l’ingresso nelle cellule.
La vaccinazione, inoltre, attiva anche le cellule T che preparano il sistema immunitario a rispondere a ulteriori esposizioni a SARS-CoV-2
Il vaccino, quindi, non introduce nelle cellule di chi si vaccina il virus vero e proprio, ma solo l’informazione genetica che serve alla cellula per costruire copie della proteina Spike. Se, in un momento successivo, la persona vaccinata dovesse entrare nuovamente in contatto con il SARS-CoV-2, il suo sistema immunitario riconoscerà il virus e sarà pronto a combatterlo.
L’mRNA del vaccino non resta nell’organismo ma si degrada poco dopo la vaccinazione.
Che cosa contiene?
Il COVID-19 mRNA BNT162b2 (Comirnaty) contiene un RNA messaggero che non può propagare se stesso nelle cellule dell’ospite, ma induce la sintesi di antigeni del virus SARS-CoV-2 (che esso stesso codifica). Gli antigeni S del virus stimolano la risposta anticorpale della persona vaccinata con produzione di anticorpi neutralizzanti. L’RNA messaggero è racchiuso in liposomi formati da ALC-0315 ((4-idrossibutil)azanediil)bis(esano-6,1-diil)bis(2-esildecanoato) e ALC-0159 (2-[(polietilenglicole)-2000]-N,N-ditetradecilacetammide). ALC-0315 e ALC-0159 sono lipidi sintetici che contribuiscono a formare le vescicole che veicolano il vaccino. Il vaccino contiene inoltre altri eccipienti:
1,2-Distearoyl-sn-glycero-3-phosphocholine
colesterolo
potassio cloruro
potassio diidrogeno fosfato
Sodio cloruro
Fosfato disodico diidrato
saccarosio
acqua per preparazioni iniettabili
Efficacia e sicurezza della vaccinazione
La sperimentazione è stata abbreviata per avere presto il prodotto? Testato su un numero di persone dieci volte superiore agli standard degli studi analoghi per lo sviluppo dei vaccini. Non è stata saltata nessuna delle regolari fasi
Gli studi sui vaccini anti COVID-19, compreso il vaccino COVID-19 mRNA BNT162b2 (Comirnaty), sono iniziati nella primavera 2020, perciò sono durati pochi mesi rispetto ai tempi abituali, ma hanno visto la partecipazione di un numero assai elevato di persone: dieci volte superiore agli standard degli studi analoghi per lo sviluppo dei vaccini. Perciò è stato possibile realizzare uno studio di grandi dimensioni, sufficienti per dimostrare efficacia e sicurezza.
Non è stata saltata nessuna delle regolari fasi di verifica dell’efficacia e della sicurezza del vaccino: i tempi brevi che hanno portato alla registrazione rapida sono stati resi possibili grazie alle ricerche già condotte da molti anni sui vaccini a RNA, alle grandi risorse umane ed economiche messe a disposizione in tempi rapidissimi e alla valutazione delle agenzie regolatorie dei risultati ottenuti man mano che questi venivano prodotti e non, come si usa fare, soltanto quando tutti gli studi sono completati. Queste semplici misure hanno portato a risparmiare anni sui tempi di approvazione.
Quanto è efficace? Al 95%
I risultati degli studi hanno dimostrato che due dosi del vaccino COVID-19 mRNA BNT162b2 (Comirnaty) somministrate a distanza di 21 giorni l’una dall’altra possono evitare al 95% degli adulti dai 16 anni in poi di sviluppare la malattia COVID-19 con risultati sostanzialmente omogenei per classi di età, genere ed etnie.
Il 95% di riduzione si referisce alla differenza tra i 162 casi che si sono avuti nel gruppo degli oltre 18mila che hanno ricevuto il placebo e i soli 8 casi che si sono avuti negli oltre 18mila che hanno ricevuto il vaccino.
La protezione è efficace subito dopo l’iniezione? Dopo una settimana dalla seconda dose
No, l’efficacia è stata dimostrata dopo una settimana dalla seconda dose.
Quali reazioni avverse gravi sono state osservate durante la sperimentazione?
L’unica reazione avversa severa più frequente nei vaccinati che nel gruppo placebo è stato l’ingrossamento delle ghiandole linfatiche. Si tratta, comunque, di una patologia benigna che guarisce da sola.
In generale, le reazioni sistemiche sono state più frequenti e pronunciate dopo la seconda dose.
Nei Paesi dove è già stata avviata la somministrazione di massa del vaccino sono cominciate anche le segnalazioni delle reazioni avverse, da quelle meno gravi a quelle più significative, comprese le reazioni allergiche. Tutti i Paesi che avviano la somministrazione del vaccino estesa a tutta la popolazione raccoglieranno e valuteranno ogni segnalazione pervenuta al sistema di farmaco vigilanza delle reazioni averse al vaccino, così da poter definire con sempre maggior precisione il tipo di profilo di rischio legato alla vaccinazione.
Quali vaccini arriveranno in Italia e quando?
Sul sito https://info.vaccinicovid.gov.it si legge che: le tempistiche e le cifre potranno essere soggette a variazioni in funzione dei processi di autorizzazione e assegnazione delle dosi.
L’Italia, in base agli accordi stipulati, potrà contare sulla disponibilità delle seguenti dosi:
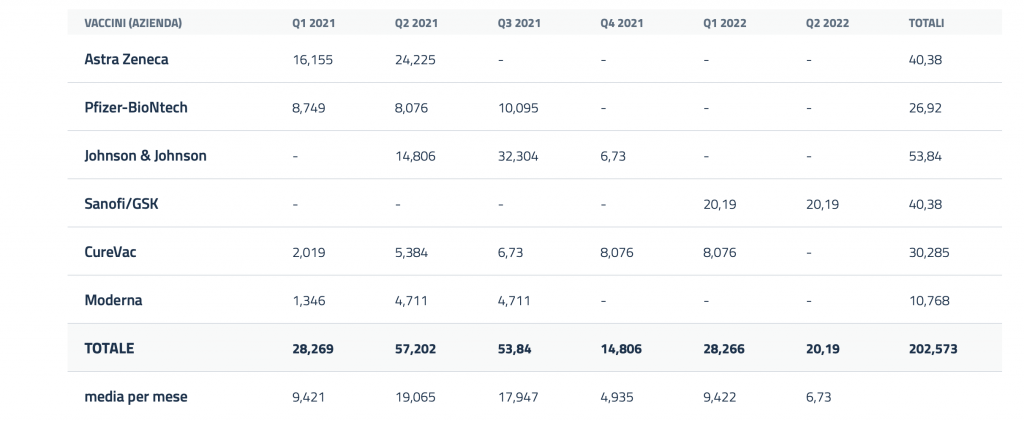
Stima quantità di dosi di vaccino disponibili (in milioni) in Italia, per trimestre (Q) e per azienda produttrice, in base ad accordi preliminari d’acquisto (APA) sottoscritti dalla Commissione europea e previa Autorizzazione all’Immissione in Commercio (AIC).